光SN 1反応とは
一般に光分解性分子とは、光照射によって分解するような分子のことを意味します
この光分解形式には様々なものがあり得るのですが、中でも光SN 1反応は扱いやすさや応用性により注目されています
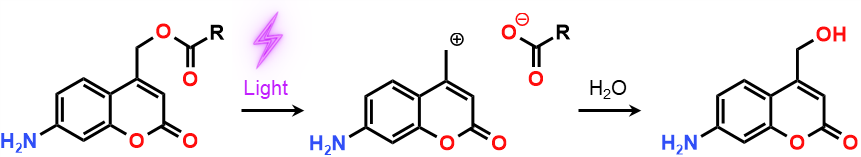
光SN 1反応とは、分子が光を吸収すると脱離基が解離し、その後の付加反応によって完全分解に至るという反応のことを指します
代表的なものとしては、4-クマリニルメチルエステル(クマリンのエステル)が知られています
この例では、クマリン骨格が光を吸収すると、クマリニルメチルカチオンとカルボキシアニオンへの分解が起こり、その後の水付加によってクマリニルメチルアルコールと対応するカルボン酸を生成します
ここで、生成するカルボン酸を薬となるように分子設計してしまえば、光照射によって体内の狙った箇所にのみ薬を生成してくれるような、新たな薬剤を開発することができるわけです
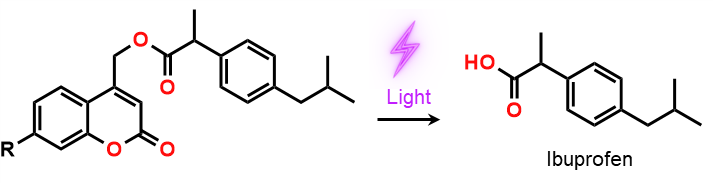
具体的な薬としては、イブプロフェンを用いた報告例があります[1]
このように体内の狙った箇所のみに薬を適用させることは、副作用の低減などにつながります
問題:どんな構造の分子が光SN 1反応を起こすのか
では、クマリンのエステルが光分解することは分かったわけですが、この現象はどれくらい一般的なのでしょうか?
クマリンよりも一般的な構造を有する、アリルエステルでもこのような光分解が起きるのでしょうか?
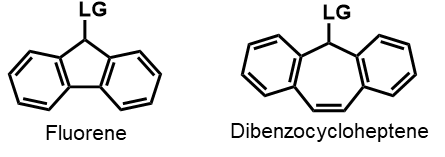
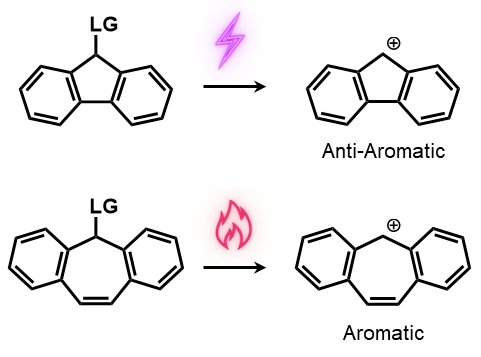
理解を深めるために、こちらの2つの分子、フルオレンとジベンゾシクロヘプテンについて注目してみましょう
LGはLeaving Group(脱離基)を意味しますので、この箇所の1原子目にはエステルなどの酸素原子が当てはまります
つまり、両分子はどちらも-C=C-CH2 -O-というアリルエステル的な骨格を有していますが、片方だけが光分解性を示します
どちらが光分解するか、考えてみてください
ヒントは、LGが脱離した際に生じるカチオンの構造を考えてみることです
片方は(4n)πの反芳香族的な構造になりますが、もう片方は(4n+2)π系の芳香族的な構造になります
・
・
・
解答
それでは解答に移ります
カチオンが反芳香族性となるのはフルオレンの方で、芳香属性となるのはジベンゾシクロヘプテン、というところまでは簡単だと思います
問題はここからです
光反応においても通常通り、安定な芳香属性の分子が生成すると、つい考えてしまいませんでしたか?
その逆を考えられた方は、さすがです
すなわち、光によって脱離基の解離が起きるのは、反芳香属性のカチオンを生成する方になります!
言い換えれば、フルオレン骨格は光による分解性を示しますが、ジベンゾシクロヘプタン骨格は光による分解性を示しません
後者は代わりに、熱による分解性を示すことになります
このような違いは何に由来するのでしょうか?
この詳しい解答については文献[2]に記載されておりますが、本記事ではこれについて軽く解説することとします
この問題を考えるための鍵は、基底状態と励起状態のポテンシャルエネルギー曲面にあります
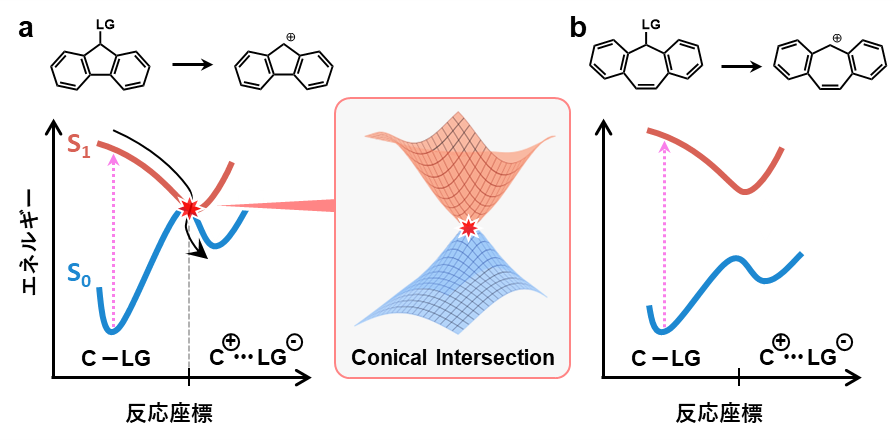
フルオレンユニットとジベンゾシクロヘプタンユニットのポテンシャルエネルギー曲面を見てみましょう(図a, b)
まず図aに着目します
この場合生成されるのは通常不安定な反芳香族性分子ですから、その基底状態(S0 状態)のポテンシャル曲面は高い位置にあります
対照的に、その励起状態(S1 状態)は安定であり、ポテンシャル曲面が低い位置にあります(Baird則)
すると、基底状態のポテンシャル曲面と励起状態のポテンシャル面がある箇所で交差することになります(図の赤星)
この点をConical Intersection(CI, 円錐交差)と呼びます
(円錐交差という名前はおそらく、反応座標が一般に多次元となる以上、曲線よりも曲面の交差点としてイメージされる方が現実に近かったことに由来しています)
円錐交差の反応座標にある分子からしてみれば、S1 状態かS0 状態かの区別はどちらでもいいことになるわけです
そこでこの交差点に入ってしまった分子は、このまま対応するカチオンのS0 状態へ移行します
以上が、反芳香族性カチオンを生成する分子が光分解性を獲得する理由となります
次に、図bに着目します
この場合生成されるのは、基底状態が安定な芳香属性カチオン分子となります
これは言い換えれば、その基底状態のポテンシャル曲面が全体的に低い位置にあり、励起状態のポテンシャル曲面は高い位置にあることに対応します
その結果、2つのポテンシャル曲面は交差せず、それぞれ独立して存在することとなります
この場合、励起状態からカチオンの基底状態にアクセスすることは困難となりますから、別の経路を経て元の基底状態に戻るなどといった失活経路のほうが顕著になるわけです
したがって、芳香属性カチオンなどの安定な化学種は、光SN 1反応においては生成しにくいということになります
光SN 1反応を起こす分子の見つけ方
結局、どんな分子が光SN 1反応を起こすのかを気にされる方も多いと思います
実は計算化学的手法を用いることで、分子に光SN 1型分解性があるかを調べることができます
といっても、S0 状態とS1 状態のエネルギーが等しくなる反応座標を見つければよいのですが、この計算は一般に難しいです
そこで直接CIを見つける代わりに、”カルボカチオン”のS0 -S1 エネルギーギャップを計算し、その大きさから光SN 1型分解性の有無を判断することができます
実はこれが論文[2]の主題でして、簡単に表せば以下の図の通りとなります
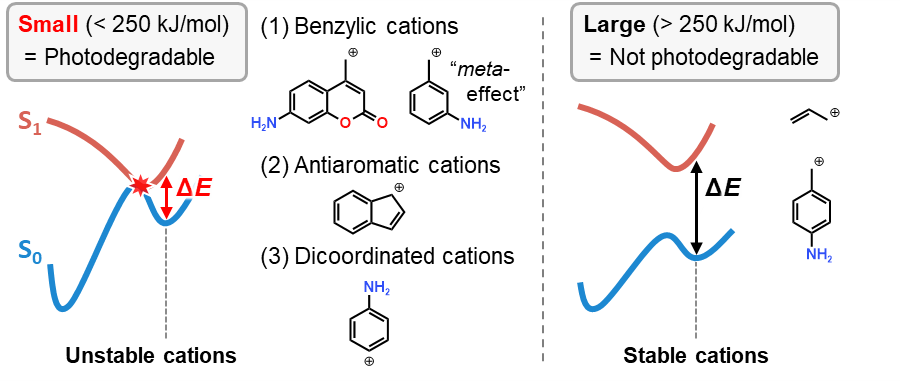
図より明らかですが、CIを有する光分解性分子のΔEは小さい一方、CIをもたない非光分解性分子のΔEは大きいです
その大きさの指標として、具体的には250 kJ/mol (60 kcal/mol)あたりが境界になることが報告されています
ここで計算よりももっと簡単に、光SN 1型分解性分子を把握したいという方もいるかと思います
そういった方は、図にある3タイプのカルボカチオンを抑えておくとよいでしょう
いずれも比較的不安定なカルボカチオンであり、(1)ベンジルカチオン、(2)反芳香属性カチオン、(3)二置換型カチオンの3タイプとなります
p -アミノベンジルユニットは光分解しない一方、m -アミノベンジルユニットは光分解可能であることは、実は以前からmeta effectとして知られていたりします
またクマリンの光分解は知られすぎて特に意識されないかと思いますが、実は級数で見れば最も不安定な一級カルボカチオンを経由するんですね
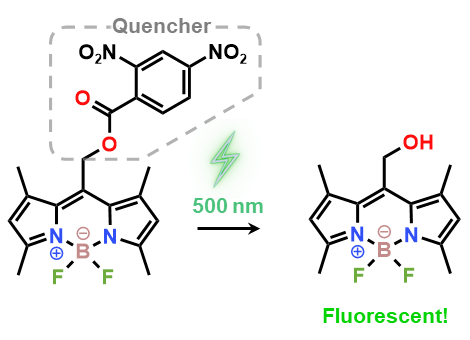
最後のクイズ:この分子は光SN 1型分解性を示しますか?
ここまでで勉強していただけたかと思いますので、最後にテストです
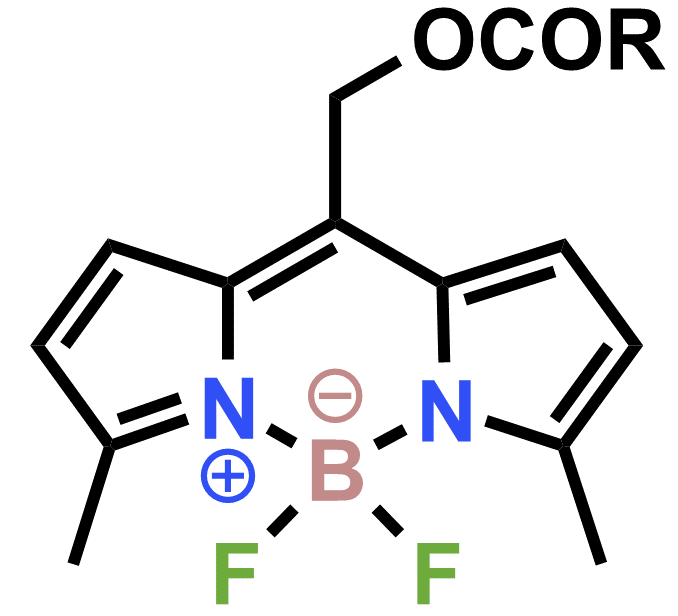
以下のBODIPY骨格を有するエステル分子は、光SN 1型分解を示すでしょうか?示さないでしょうか?
・
・
・
正解を発表します
ここまできて光分解性を示さない分子を出題することがそもそもあり得ないというのもありますが、この分子は光SN 1型分解を示します![3]
この文献[3]の著者は、文献[2]と同じくArthur Winter氏のグループの方です
文献[2]で得られた知見を生かして、新しい光分解性分子を開発したというわけですね
この分子はUV光よりも安全な波長500 nm程度の光で分解できるという利点があります
また上図の通り、光分解によって蛍光クエンチャーが外れることで蛍光性分子に変化するという機構を利用し、細胞のイメージングも行われています
文献[2], [3]はどちらもJACSに掲載されていますので、JACSがお代わりされてしまったということになります。すごい!
以上、ポテンシャルエネルギー曲面と光SN 1型分解機構の関係でした
Reference
[1]
J. Mater. Chem. 2012 ,
22 , 6680.
[2]
J. Am. Chem. Soc. 2014 ,
136 , 25, 8933.
[3]
J. Am. Chem. Soc. 2015 ,
137 , 11, 3783.