⓪目次
③解決策
以上の①背景と②問題点にて、アントラセン架橋型ダブルネットワーク材料が抱えるループ生成問題について述べました。
GAINENZでは、当該問題に対する解決策を提示させていただきます。
光修復を達成しつつも材料内にループを生成させないような新しい架橋剤として、図10のようなDNA-アントラセン複合型架橋剤が利用可能です。
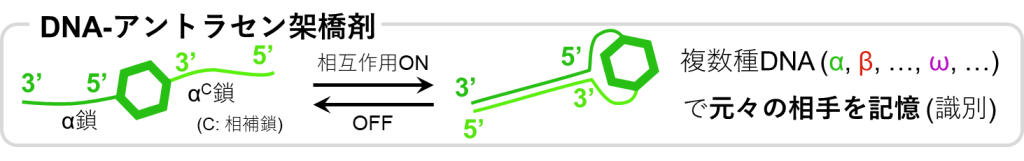
このアントラセンの一端にはDNAの一本鎖が連結されており、これをα鎖とすると、アントラセンのもう一端には相補鎖であるαC鎖が連結されているものとします。
通常、これら一本鎖同士の相互作用は絶たれていますが、外部刺激によってその相互作用を生じさせ、二重鎖を形成させることができるものとします。
このようなDNAをα鎖だけでなく、複数種類(β, γ, δ, …)用いることによって、元々結合していたアントラセン同士のペアを区別することが可能となります。
この原理の詳細については、図11に示した通りとなります。
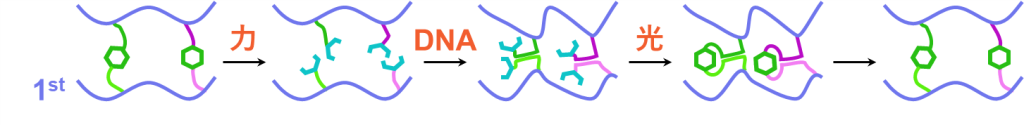
初期状態ではα鎖とαC鎖、β鎖とβC鎖、γ鎖とγC鎖、…といった各DNAペアの結合したアントラセン二量体により、1stネットワークが架橋された状態となっています。このときpHは10より大きく、DNA同士の相互作用は絶たれています。
続いては応力の印可により、ネットワーク材料が引っ張られるとします。このときは従来通り、アントラセン二量体が開裂し、蛍光性のアントラセンを生じると期待されます。この状態で光照射されると近傍のアントラセン同士で二量体の形成が進み、やはりループを生成すると考えられます。
そこで元々のアントラセンペアを区別するために、DNAの相互作用を活用します。酸などによってpHを操作することで、DNA同士の相互作用をONにできます。すると、α鎖はαC鎖と、β鎖はβC鎖と、γ鎖はγC鎖と二重鎖を形成します。この時点ではアントラセンは開裂したままですが、元々のペア同士がかなり近い距離に位置することとなります。そこで光を照射し二量体形成を進めれば、近傍のアントラセン同士で二量化が進むため、元のアントラセン二量体が復活し、最後にDNA同士の相互作用を切ることによって完全な初期状態に戻ると予想されます。
以上が、アントラセン-DNA複合型架橋剤を用いたダブルネットワーク材料の修復メカニズムとなります。
DNAが何種類必要かの予測は難しいですが、これは本研究における根源的な問いに相当します。
では、DNAとアントラセンを組み合わせた研究自体については、どのようなものが知られているのでしょうか?
実現可能性を判定する上でも、これを調べておく必要がありますね。
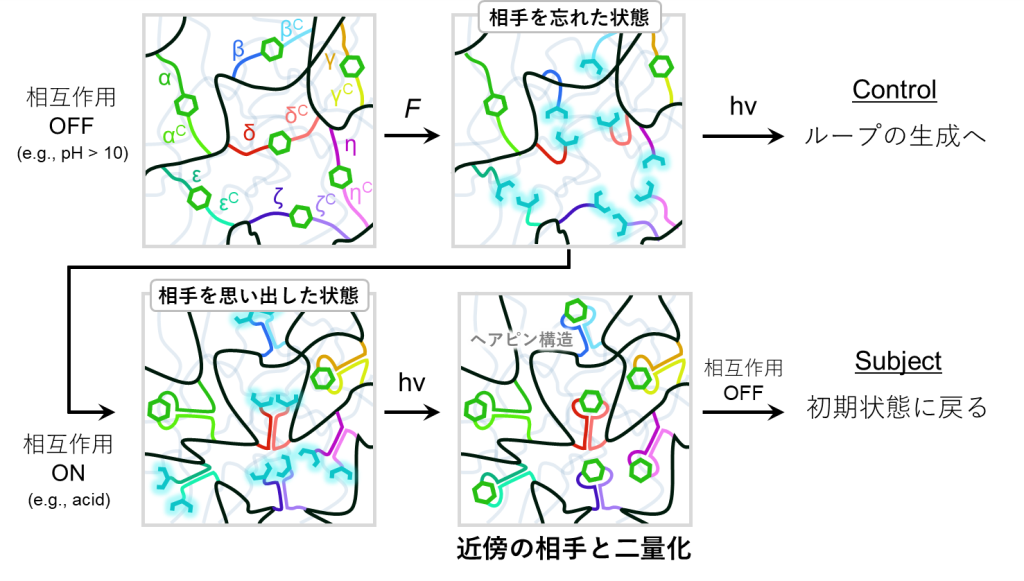
まず、重要な先行研究としては図12上の研究が挙げられます。
この研究では、アントラセンの結合した2種のDNA一本鎖を、予め他のDNAテンプレートと二重鎖形成させておくと、二量化反応が進行することを証明しています(反対に、変異を取り入れることで二重鎖形成させなかった場合には二量化が進行しません)。
また、その後の研究ではアントラセンがDNA鎖の末端に位置している場合でも本手法が有効となることや、三重鎖DNAにも適用可能であることが証明されています(図12下)。
以上から、本提案のDNA-アントラセン複合型架橋剤を用いれば、DNAの相互作用を介することによって元々のアントラセンペアを再結合させることが容易になるわけです。
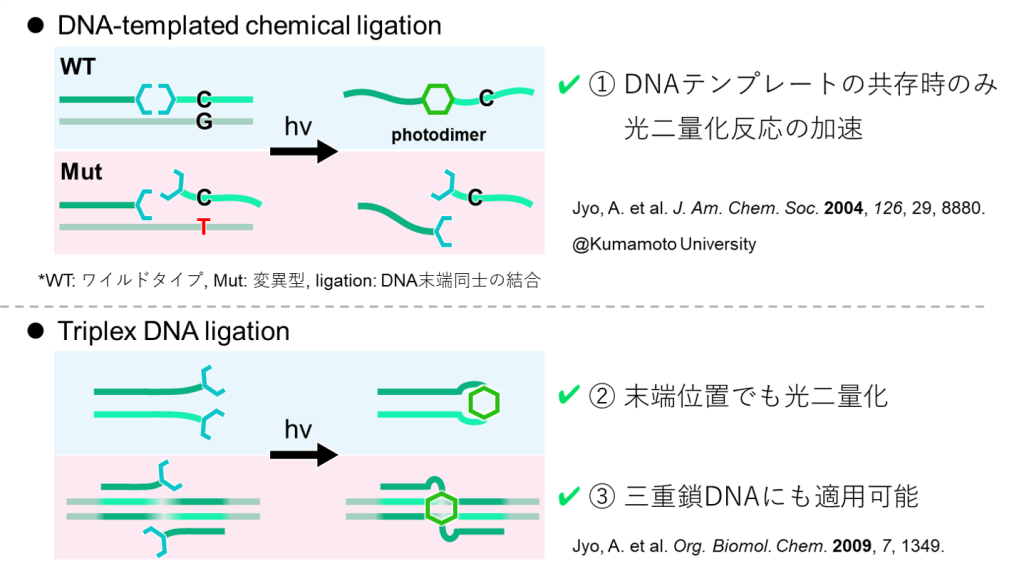
また、DNAを活用したポリマーの架橋方法については従来より、図13に示す6通りが知られています。
それぞれを列挙すると、1. 塩基対の形成(非共有結合の利用)、2. ライゲーション(共有結合の利用)、3. DNA間の架橋、4. モノマーへのDNA修飾および重合、5. ポリマーのDNAによる架橋、6. ナノ粒子や生体高分子へのDNA修飾、となります。
本提案の架橋法7が最も類似するのは5の手法となりますが、本提案ではDNAの利用を一時的に限定することによってアントラセンの機能を補助できるため、DNA利用法の位置付けとしては完全に新規であることが分かります。
続いては、DNAによる架橋法をゲル材料に適用した例をご紹介します。
主には、DNA架橋を①DNゲルの形成に活用した例と、②ゲルの自己集合に活用した例が知られています(図14) 。
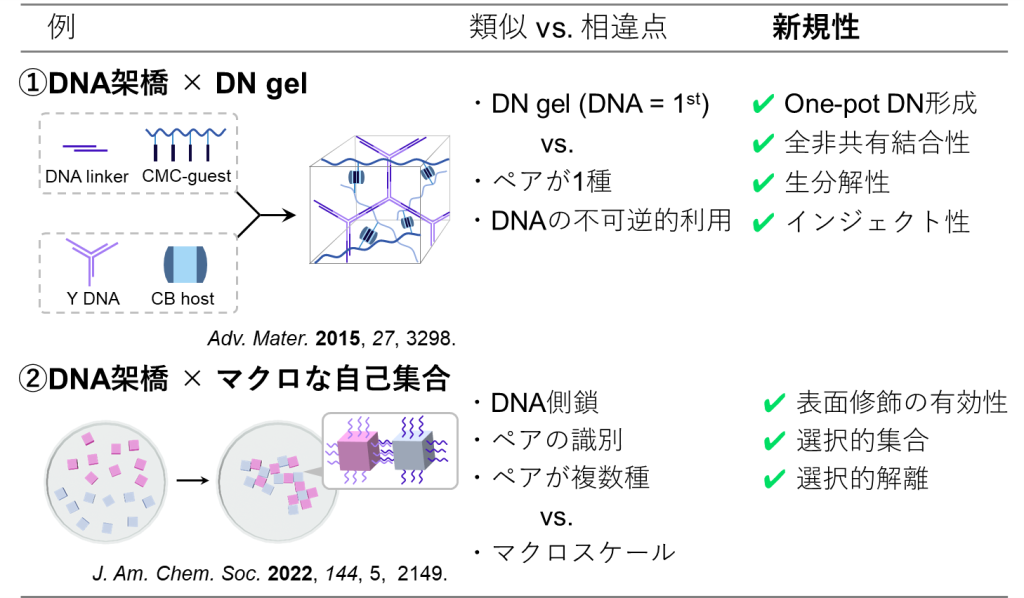
①の例では、[1]DNAリンカーとカルボキシメチルセルロース(CMC)、[2]Y型DNAとククルビットウリル(CB)をそれぞれ含む[1], [2]の溶液を混合させます(図15) 。
するとDNAリンカーはY型DNAと、CMCはCBと選択的に結合するため、同じ溶液内で2種のネットワークが形成され、結果的にダブルネットワーク材料がone-potで生成します。
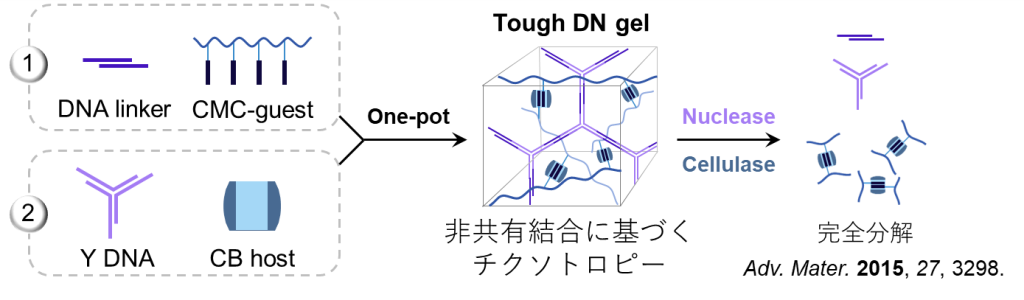
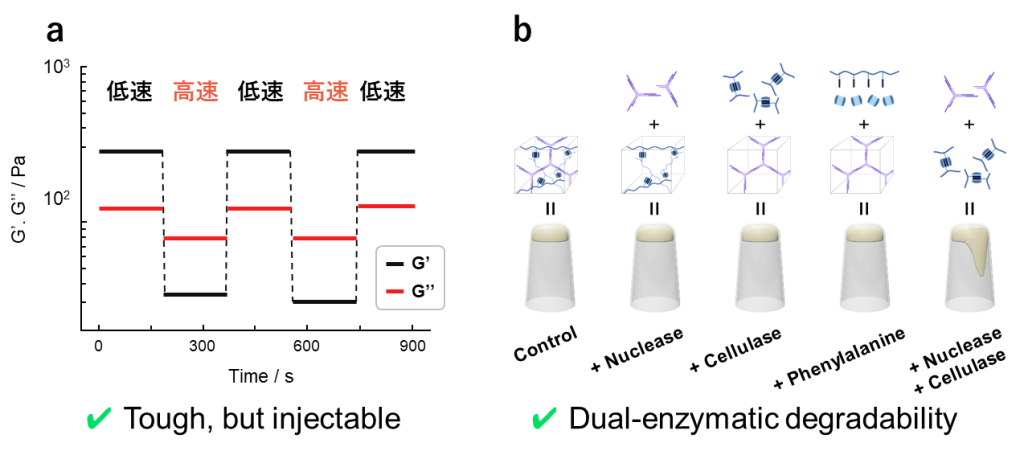
得られたDNゲルは非共有結合によって形成されているため、タフでありながらも高周波においては溶液的な挙動を示します(図16a) 。
また本ゲルの分解性についても調査されており、DNAを切断するヌクレアーゼとセルロースを切断するセルラーゼを添加することによって分解できることが明らかとなっています(図16b) 。
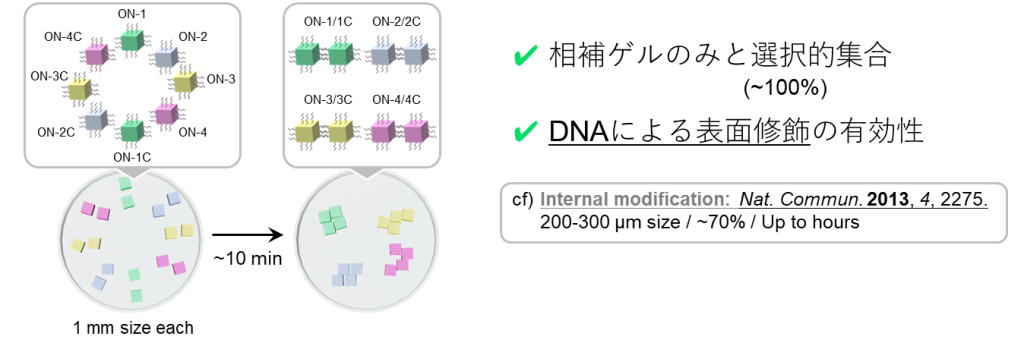
最後に、②のゲルの巨視的自己集合について、その概要を図17に示します。
図の例では立方体型ゲルが2種類ありますが、各表面にはアジド基が付与されており、クリック反応を介して、アルキン付きのDNA鎖をゲルに修飾することができます。
ここで、それぞれのゲルに対して修飾するDNAが相補的な塩基配列をもつように設計しておくと、ゲル同士がDNA同士の結合を通して巨視的に集合することができます。
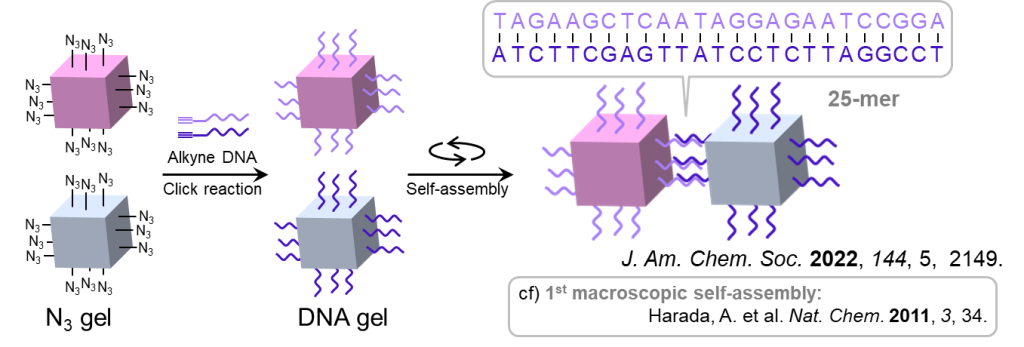
この相補的な相互作用は選択性が高いため、異なるDNAの修飾されたゲルが4ペアあるような場合であっても、設計通りに自己集合させられることが示されています(図18) 。
したがって、以上①・②の結果は、本提案の主軸となるDNA同士の相互作用が、ゲル中・ゲル表面環境であっても高い選択性で進行することを支持しています。
本提案のまとめを図19に示します。
本提案は1stネットワークの架橋において、DNA-アントラセン複合型架橋剤を利用するというアイデアでした。
この構造は力が加わると開裂を起こし、生じたアントラセンに基づくメカノフルオロクロミック特性を示すと期待されます。
ここで本構造に対し、従来通りに光照射を行ってしまうとループが生成され、修復サイクルごとに機械特性が低下すると予測されます。
一方、DNA同士の相互作用をONにすれば元々のアントラセンペアを近傍に位置させることができ、光によって近傍のアントラセン同士を選択的に再結合させることができます。
これによって元のアントラセンペア、ならびに初期のネットワーク構造を再生できます。
したがって、本提案のメカニズムを用いるとループの生成を抑制でき、高い回復率を伴った材料の光修復が可能となるわけです。
DNA架橋 × DNゲル × 光修復 × メカノクロミック特性という重要なテクノロジーを有効に組み合わせることで、ループの生成に関する基礎科学的な知見を与えつつも、高い相乗効果を伴った材料高機能化を実現させることができます。









コメントを残す
コメントを投稿するにはログインしてください。